蛋白质分离纯化方法(图文)
日期:2015年06月01日 信息来源:深圳市纽邦生物科技点击率:7367
蛋白质的分离纯化
(一)材料
1、选材
2、破碎
3、混合物的分离
(二)粗分级
(三)细分级
(四)结晶
蛋白质的分离方法
根据蛋白质的溶解度差异分离 —沉淀技术
根据蛋白质分子大小的差异分离
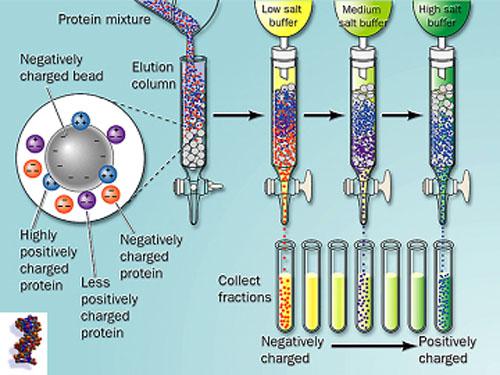
根据蛋白质的荷电差异分离
根据蛋白质与某些物质的吸附差异—吸附分离
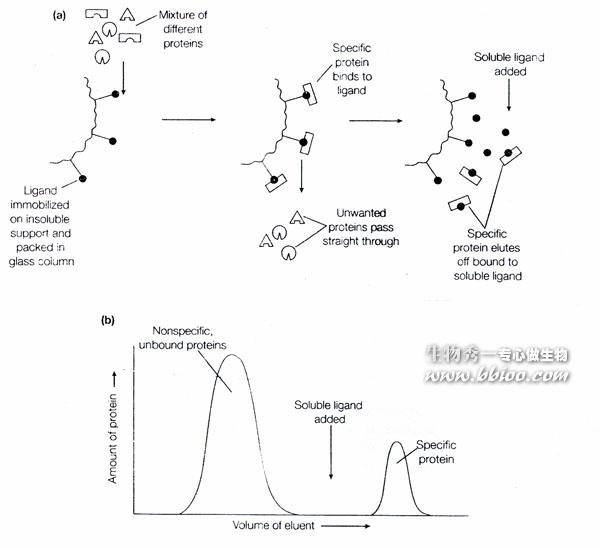
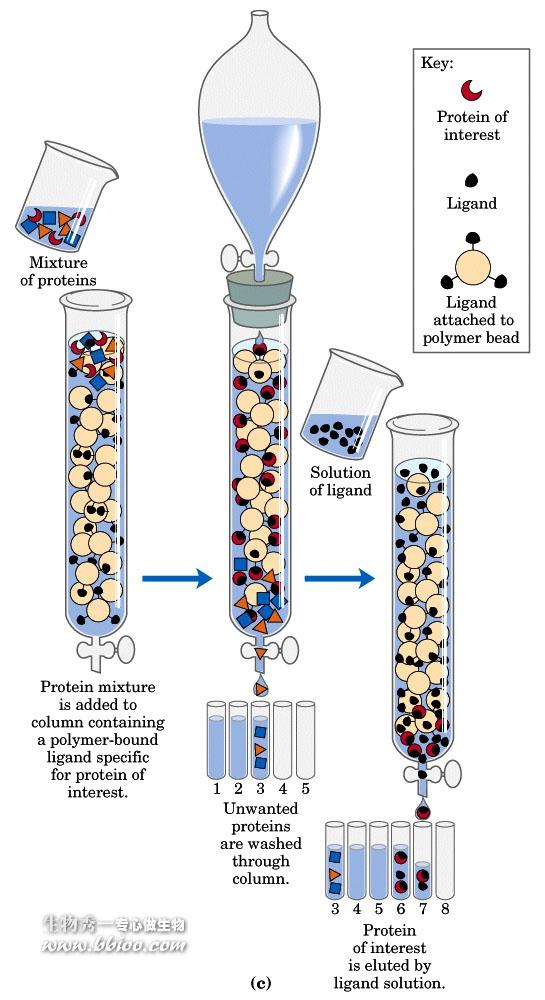
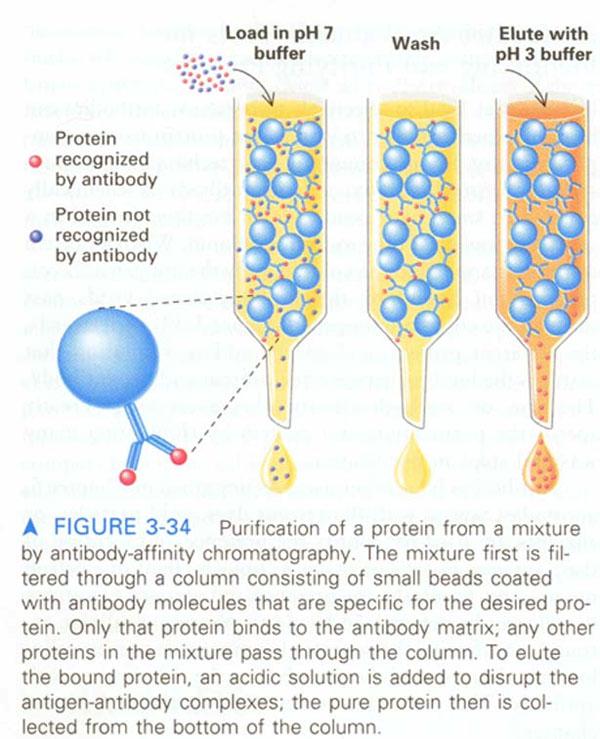
利用生物分子专一性结合的特性—亲和层析
蛋白质的分离方法
可逆沉淀:等电点沉淀、盐析法、有机溶剂沉淀
不可逆沉淀:热变性沉淀、重金属盐沉淀、有机酸沉淀
透析——只用于除盐类和小分子杂质
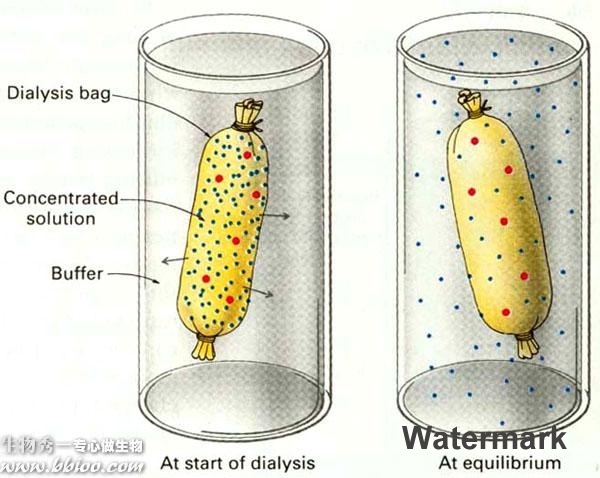
透析——只用于除盐类和小分子杂质
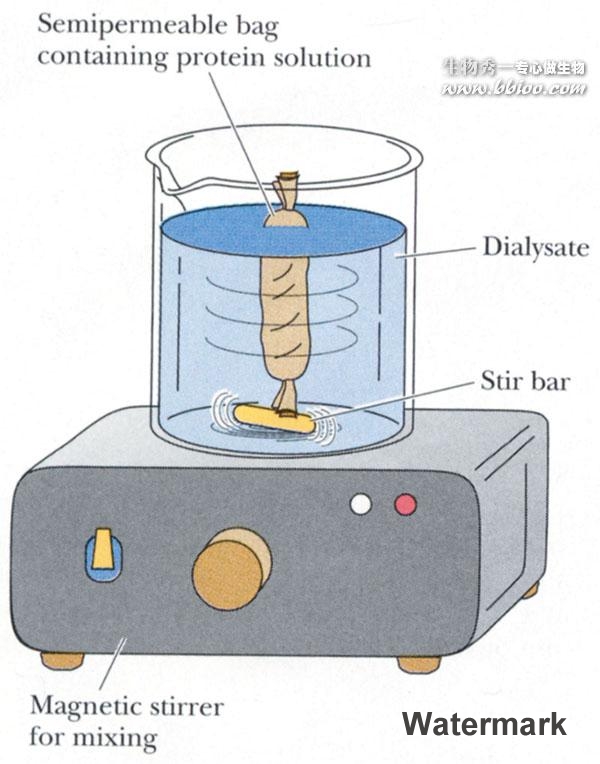
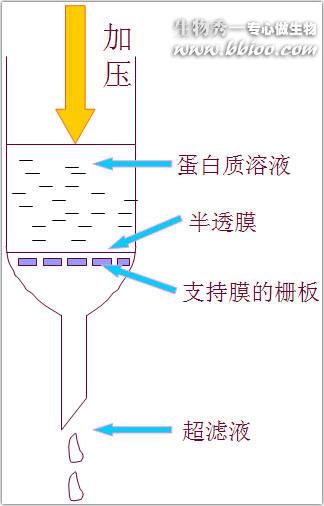
超过滤——除小分子杂质,分离、浓缩蛋白质
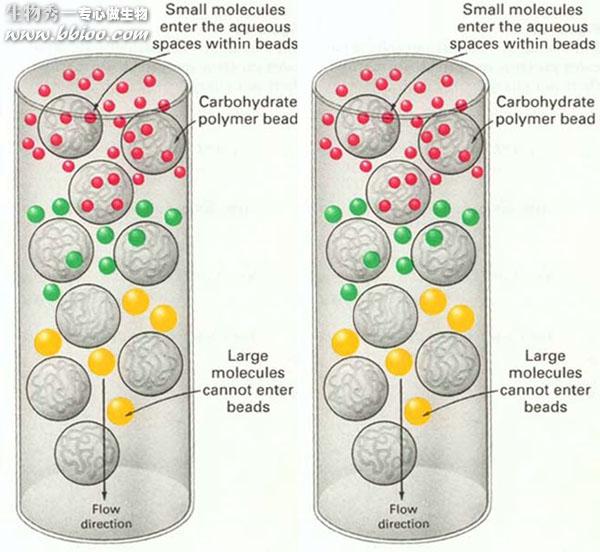
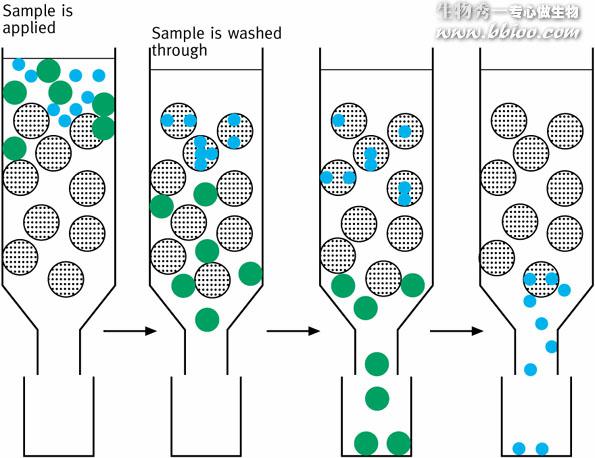
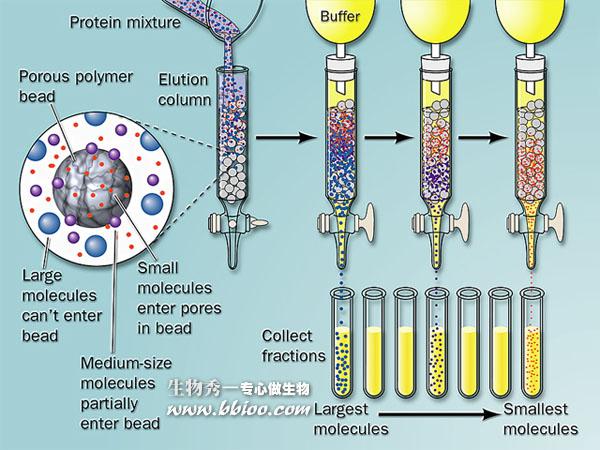
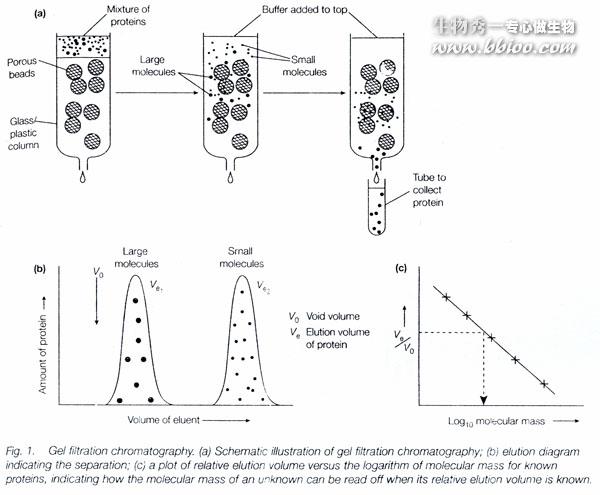
凝胶层析又叫分子筛层析。
分子筛是具有三维空间网状结构的物质,有天然的,也可人工合成。根据网孔不同可制成不同规格。
具备条件:1惰性,2水不溶性,3能高度水化。
常用分子筛:
葡聚糖凝胶(Sephadex)
型号:G200、 G150、 G100、 G75、 G50、 G25、 G15
分离大蛋白质、小蛋白质,除盐
琼脂糖凝胶(瑞典Sepharose、美国Bio-GelA)
孔径大,用于分离大分子物质
聚丙烯酰胺凝胶( Bio-GelP)
原理:
1、分子量大的物质不能进入凝胶粒子内部,随洗脱液从凝胶粒子之间的空隙挤落下来,所以大分子物质迁移速度快;
2、小分子物质要通过凝胶网孔进入凝胶粒子内部,所以小分子物质迁移速度慢。
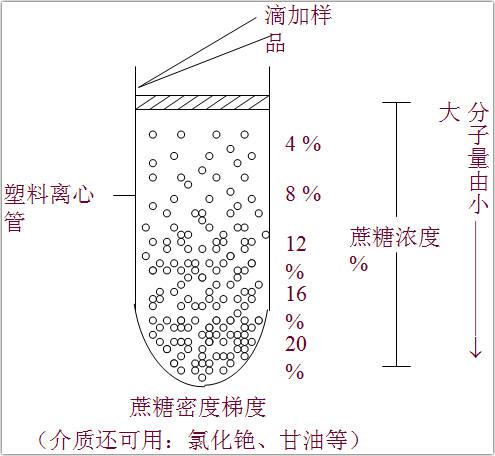
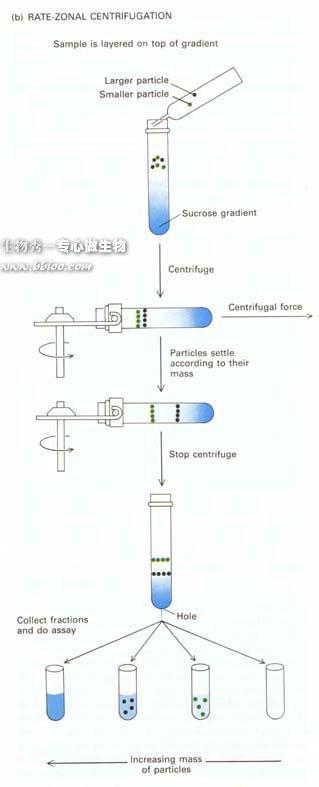
密度梯度离心
电泳法
类型:1、区带电泳
纸电泳、醋酸纤维素薄膜电泳、粉末电泳、细丝电泳、凝胶电泳。
凝胶电泳包括:琼脂糖凝胶、淀粉凝胶、硅胶凝胶、聚丙烯酰胺凝胶。
聚丙烯酰胺凝胶包括:垂直板电泳、盘状电泳、等电聚焦电泳、梯度电泳、免疫电泳。
2、自由界面电泳:支持物为溶液,很少用。
垂直板电泳
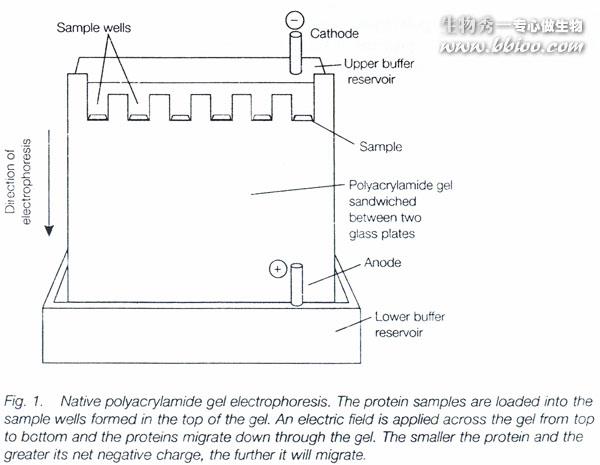
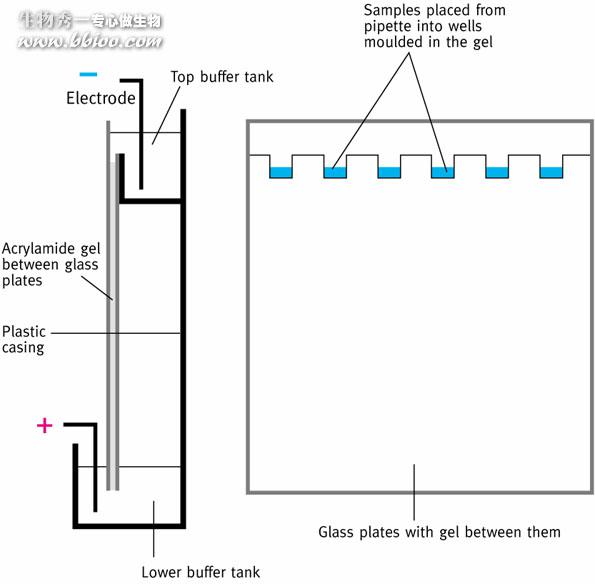
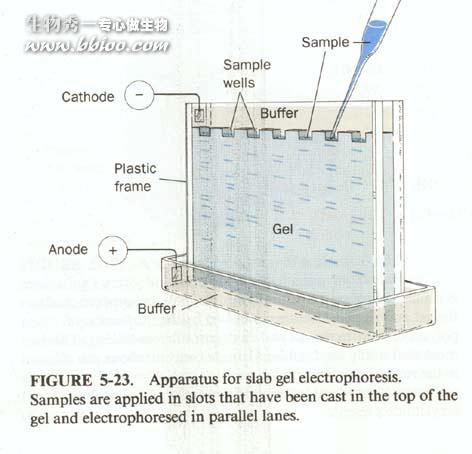
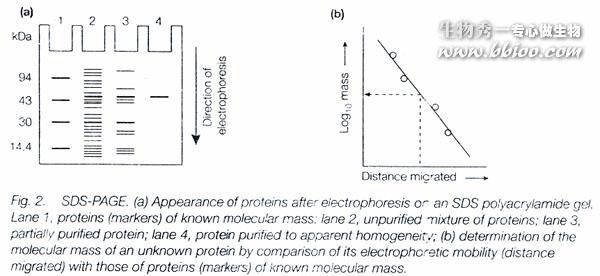
SDS—聚丙烯酰胺凝胶电泳
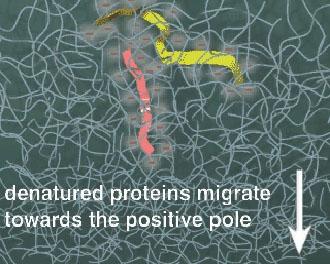
蛋白质在电场中的迁移率取决于它所带的净电荷以及分子大小和形状等因素。
加入SDS(十二烷基磺酸钠)和少量巯基乙醇,则蛋白质分子的迁移率主要取决于它的分子量,而与原来所带电荷、分子形状无关。
SDS是变性剂,它能破裂蛋白质分子中的氢键和疏水作用。巯基乙醇打开二硫键,因此使蛋白质分子处于伸展状态。此时SDS以其烃链与蛋白质分子的侧链结合成复合物,大约每两个氨基酸残基结合一个SDS分子。
导致:
1、由于SDS是阴离子,使多肽表面覆盖的负电荷远远超过蛋白质分子原有的电荷量,消除了原来的电荷差异。
2、改变了蛋白质单体分子的构象,不同蛋白质的SDS复合物的短轴长度都相同,长轴长度随其分子量的大小成正比变化。
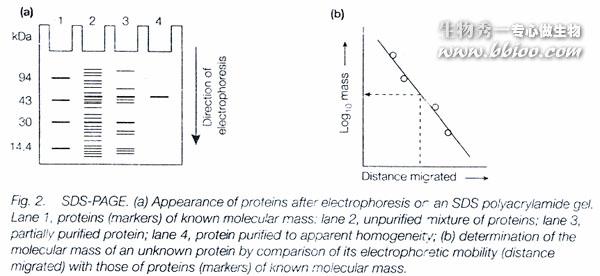
由于不同蛋白质的SDS复合物具有相同的荷质
比,并具有相似的构象,因而有如下公式:
lgM=K1—K2μR
(K1、K2为常数,μR为相对迁移率)
实际测定时,以几种标准单体蛋白质分子量的对数值对其μR作图,根据样品的μR值,从标准曲线上就可查出其分子量。
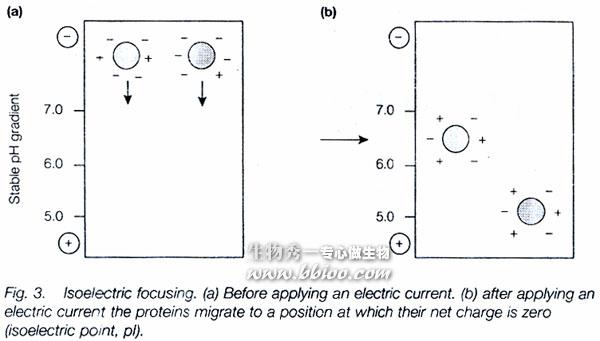
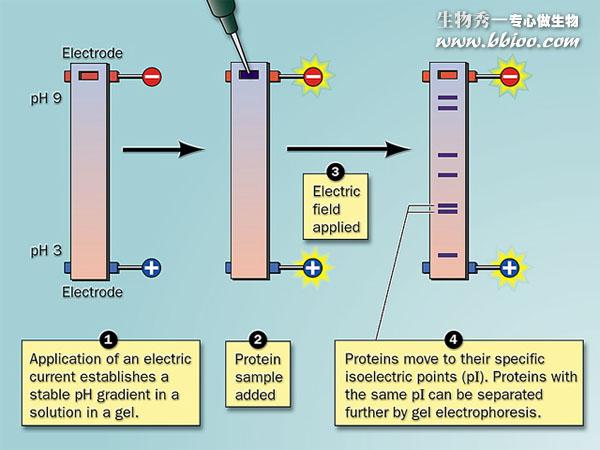
等电聚焦(Isoelectric focusing)
(1)以不同蛋白质的等电点的差异分离。
(2)凝胶中含有蛋白质样品和载体两性电解质。
(3)载体两性电解质:
a 是一系列物质的混合物。此混合物各组分的等电点要互不相同,但又不能相差太大(小数点后2位);最常用为3.0-10.0范围,还有3.0-7.0、 5.0-10.0。
b 混合物中各物质在等电点时要有足够大的电导,以保证能顺序排列;
c 混合物中各物质在等电点时要有足够大的缓冲能力,构成组分为多氨基、多羧基的脂肪族化合物;
d 要求各组分分子量要小,易于与蛋白质分离。
通电后,在介质中由于H+与OH-的相向移动,形成了从3.0-10.0的一系列pH梯度。当载体两性电解质移动到各自的等电点时,就停止移动,不带电荷,并维持pH梯度(电导、缓冲能力)。
即:pH梯度由H+与OH-建立,而由载体两性电解质来维持。当蛋白质移动到相应的pH值处,结束。
注意事项:1、时间相对长对分离有利;
2、也可用来测定蛋白质的等电点。
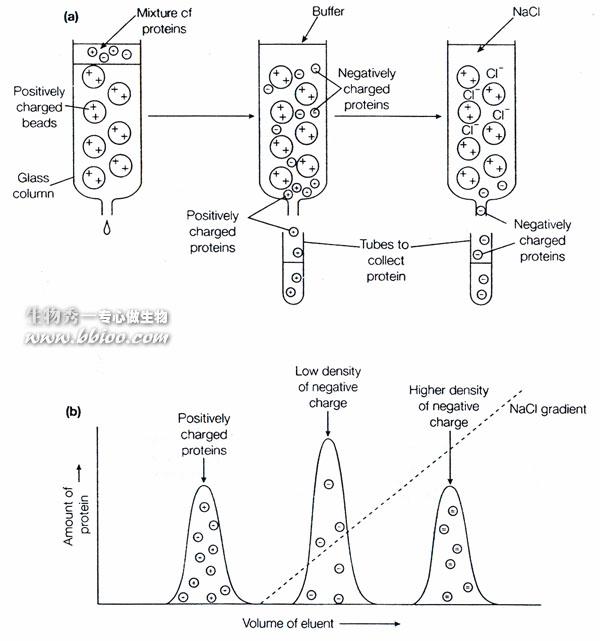
离子交换层析
可分为阳离子交换---与阴离子交换---。
1、树脂类:分离氨基酸,孔径小;
2、纤维素类:分离蛋白质,孔径大。

通过改变盐浓度,辅助改变pH值进行梯度洗脱
吸附本质:非共价连接
常用吸附剂:结晶磷酸钙、硅胶
脱附方式:1、改变蛋白质带电状态;
2、改变环境溶液的pH、离子强度等。
小 结
粗分级一般采用盐析、等电点沉淀、有机溶剂分级等方法;
细分级一般采用层析法,包括凝胶层析、离子交换层析、吸附层析、亲和层析等方法。必要时,还可采用电泳法,包括等电聚焦等作为蛋白质的提纯步骤。
蛋白质的纯度鉴定
各种细分级的方法都可以用于纯度鉴定
常用各种电泳法,比较权威的有:等速电泳、梯度电泳、等电聚焦电泳、聚丙烯酰胺凝胶电泳。
沉降分析和扩散分析
测定沉降系数和扩散系数。
溶解度恒定法
加入样品量为横坐标,样品溶解量为纵坐标,作图。如只有一个拐点则说明样品纯
蛋白质分子量的测定
最小分子量测定法
如Mb含Fe为0.335%,则
M=55.8/0.335%=16700。这就是最小分子量。
其实,真实分子量是最小分子量的n倍,n指Fe的数目,Mb的n=1,所以M=16700;而Hb用其他方法测得分子量为68000,则说Hb含4个Fe 原子。
渗透压法
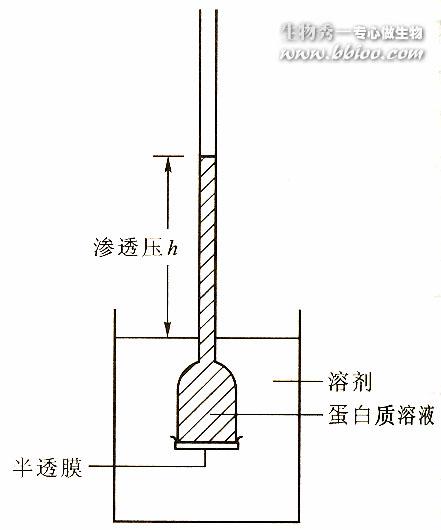
超离心法
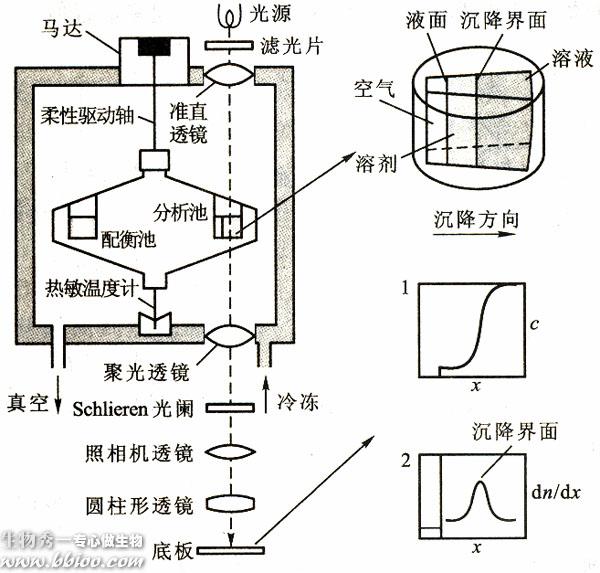
凝胶过滤法
经验公式:lgM=K1-K2Ve( K1、K2为常数)
用几种已知蛋白质,测其Ve,再对lgM作图得标准曲线。再测定未知蛋白质的Ve,可得M。
SDS-聚丙烯酰胺凝胶电泳
lgM=K1—K2μR
(K1、K2为常数,μR为相对迁移率)
凯氏定氮法
Folin-酚试剂反应
紫外吸收法
考马斯亮蓝法
双缩脲反应
此文献转载 http://bbs.biogo.net/read.php?tid=166246